1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
|
# Get a list of the bedtools output files you'd like to read in
print(labs <- paste("", gsub(".hist.all.txt", "", files, perl=TRUE), sep=""))
# Create lists to hold coverage and cumulative coverage for each alignment,
# and read the data into these lists.
cov <- list()
cov_cumul <- list()
for (i in 1:length(files)) {
cov[[i]] <- read.table(files[i])
# The value should be 1 at 0X.
cov_cumul[[i]] <- 1-cumsum(c(0,cov[[i]][,5]))
}
library(RColorBrewer)
cols <- brewer.pal(length(cov), "Dark2")
# Save the graph to a file
png("target-coverage-plots.png", h=1000, w=1000, pointsize=20)
# Create plot area, but do not plot anything. Add gridlines and axis labels.
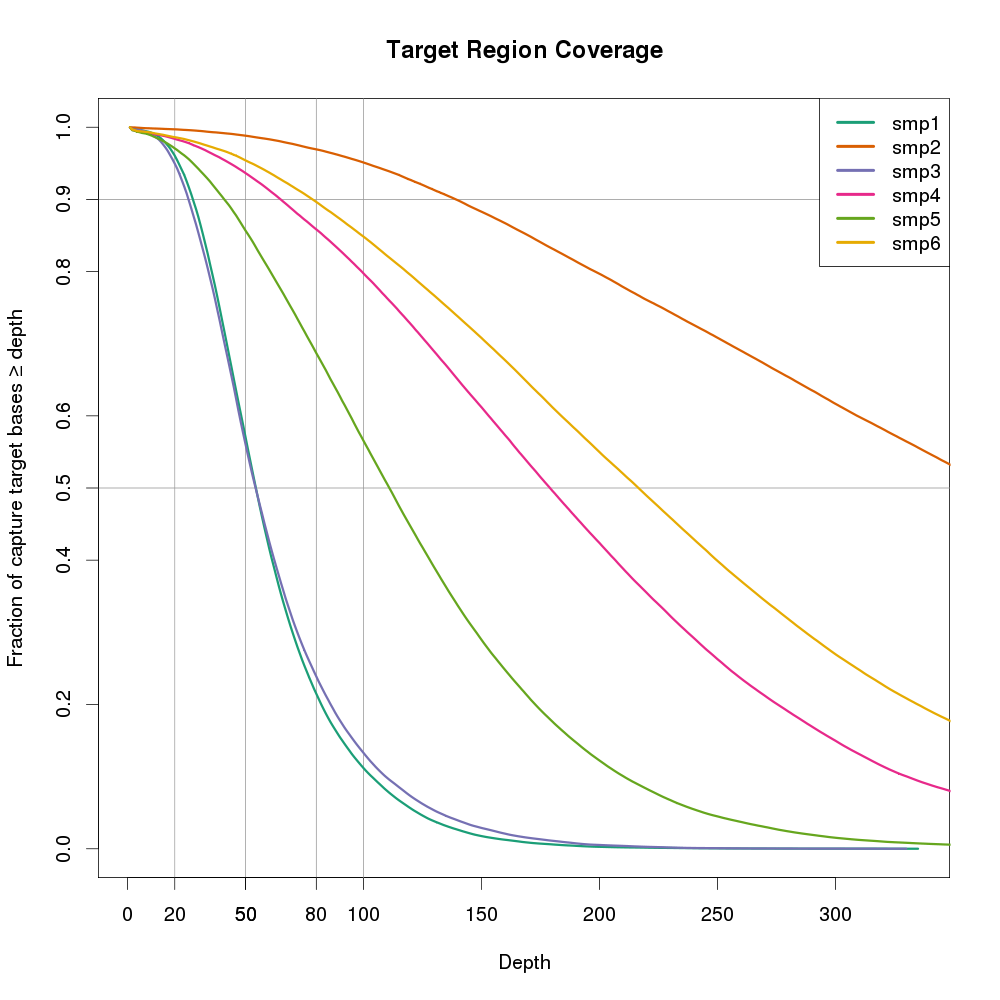
plot(cov[[1]][2:401, 2], cov_cumul[[1]][1:400], type='n', xlab="Depth", ylab="Fraction of capture target bases \u2265 depth", ylim=c(0,1.0), main="Target Region Coverage")
abline(v = 20, col = "gray60")
abline(v = 50, col = "gray60")
abline(v = 80, col = "gray60")
abline(v = 100, col = "gray60")
abline(h = 0.50, col = "gray60")
abline(h = 0.90, col = "gray60")
axis(1, at=c(20,50,80), labels=c(20,50,80))
axis(2, at=c(0.90), labels=c(0.90))
axis(2, at=c(0.50), labels=c(0.50))
# Actually plot the data for each of the alignments (stored in the lists).
for (i in 1:length(cov)) points(cov[[i]][2:401, 2], cov_cumul[[i]][1:400], type='l', lwd=3, col=cols[i])
# Add a legend using the nice sample labeles rather than the full filenames.
legend("topright", legend=labs, col=cols, lty=1, lwd=4)
dev.off()
|