pTMB (Persistent mutation burden)
文章目录
The pTMB was defined as the number of mutations in either the multi-copy or single-copy category.

肿瘤突变负荷TMB经常用在预测免疫治疗反应,但效果有时候并不是很好。这篇文章的作者评估了不太可能发生缺失loss的基因组区域中的突变情况,涉及31 种肿瘤类型 (n = 9,242) 和 8 个接受免疫治疗的队列 (n = 524)。作者发现单拷贝区域中的突变和每个细胞中存在多个拷贝的突变构成了持续性肿瘤突变负担 (persistent tumor mutation burdedn,pTMB),并且与免疫治疗反应有关。 在免疫治疗的选择性压力下,肿瘤进化过程中保留了持persistent mutation,并且具有高 pTMB的肿瘤的有更多炎症相关微环境。 pTMB的存在,阻碍癌细胞克服的进化瓶颈,因此可能在免疫治疗的背景下推动持续的免疫肿瘤控制。
目前预测免疫治疗反应,通常假设每个突变的贡献相同,也就是常用的肿瘤突变负荷TMB。但除了有错配修复缺陷的肿瘤外,TMB并不能一致在各种肿瘤中预测免疫疗法反应。之前发现,杂合突变和肿瘤新抗原可以通过染色体缺失和杂合性缺失 (LOH) 选择性消除,从而导致对免疫治疗产生抗性。根据这些发现,作者发现在免疫治疗的背景下,基因组单拷贝区域中包含的更多突变可以用来区分治疗反应。这些发现表明,单个拷贝基因组区域中的突变和相关新抗原,在治疗的选择性压力下不太可能被染色体缺失消除,因此可能导致新抗原持续的免疫反应和长期临床获益。
为了将这些发现扩展到单拷贝基因组区域之外,作者假设在单倍体区域或多拷贝中具有更多突变(pTMB)的肿瘤在免疫治疗中适应性较差。因为这种类型的突变持续暴露在免疫系统下,引起对肿瘤的免疫控制。通过染色体缺失导致的单拷贝等位基因缺失通常是不能容忍的,除非它们是相对较小的纯合缺失,因为较大的染色体缺失可能包含与突变相关的必需基因,这种往往是致命的。 同样,当突变包含在多个拷贝中时,染色体缺失导致的突变丢失在进化上是不可能的。 因此,这些“持久性”突变(persistent tumor mutation burden,pTMB)可能作为肿瘤微环境 (TME) 中肿瘤排斥的内在驱动因素。
结果
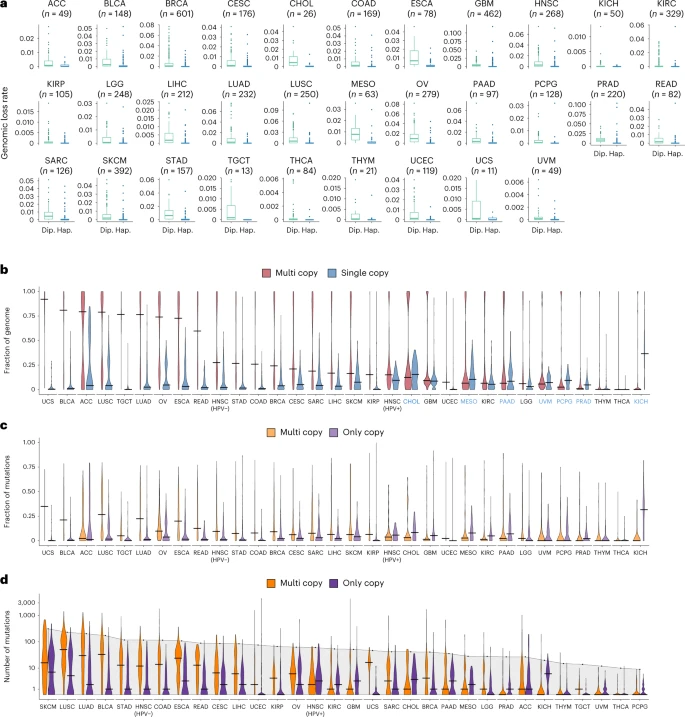
Figure 1
为了验证作者的假设,他们分析了TCGA的样本的单拷贝和整倍体缺失的基因组区域的缺失率。分析表明,单拷贝缺失率始终低于整倍体丢失率(图 1a),支持这些区域中包含的突变难以被丢失的观点。但单拷贝和多拷贝基因组比例在不同的癌种中比例不同(有高有低,1b),突变在多拷贝和单拷贝中的比例(1c)与1b的趋势一致。每种肿瘤类型中整体 TMB 并不能反映多拷贝和单拷贝突变的分布(1d),因为具有相似 TMB 的肿瘤类型表现出多拷贝和单拷贝突变的差异分布。这表明pTMB提供了一种不同于 TMB 的测量方式。
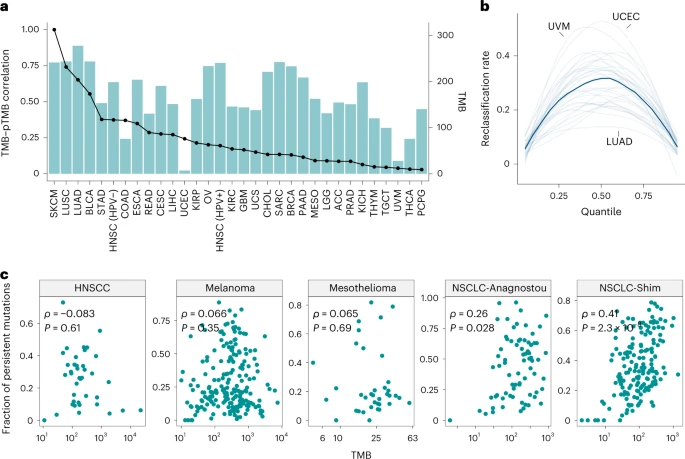
Figure 2
作者进一步评估了TMB和pTMB之间的相关性,发现在所分析的 31 种肿瘤类型中的关联存在很大程度的差异(2a),同样的,在TMB和多拷贝突变或者单拷贝突变的相关性中,不同癌症也表现出不同的相关性差异。为了了解基于 pTMB 的肿瘤重新分类的潜在可能性,作者采用了一系列从 5% 到 95% 的分位数来定义 TMB 和 pTMB 的高/低组, 这些分析显示重分类率高达 53%(范围:15-53%),所有肿瘤类型的中位重分类率为 33%(图 2b),表明基于pTMB的高低两组的样本和基于TMB高低两组的样本之间重叠率较小,提示pTMB是一个新的标志物。
作者接着来在三个肿瘤类型(黑色素瘤,非小细胞肺癌NSCLC 和间皮瘤)的七个免疫治疗队列中进一步探讨了pTMB和TMB的关系,以及一组接受 ICB 治疗的 HPV 阴性头颈癌HNSCC 队列。 与 TCGA 分析类似,作者没有检测到高TMB 的肿瘤富集高pTMB(Spearman ρ = -0.083,P = 0.61),黑色素瘤(Spearman ρ = 0.066,P = 0.35 ) 和间皮瘤队列(Spearman ρ = 0.065,P = 0.69),而在 NSCLC 队列中观察到 TMB 与pTMB之间的弱相关性(NSCLC-Anagnostou:Spearman ρ = 0.26,P = 0.03;NSCLC-Shim:Spearman ρ = 0.41,P = 2.3 × 10−8;图 2c )。 这些发现进一步支持了 pTMB 与 TMB 是不同的表征。
作者推测在persistent mutation-associated neoantigen相关新抗原 (pMANA) 的持续刺激下,固有的抗肿瘤免疫治疗反应将得到增强和维持。由于pTMB是TMB的突变子集,这些子集具有不同的权重,作者对比pTMB和肿瘤进化下更可能被丢失的突变。 作者将后者称为“易丢失”突变,这些突变占构成肿瘤 TMB 的大部分编码区域的改变。接下来作者探讨了pTMB和易丢失突变的克隆组成是否有差异。
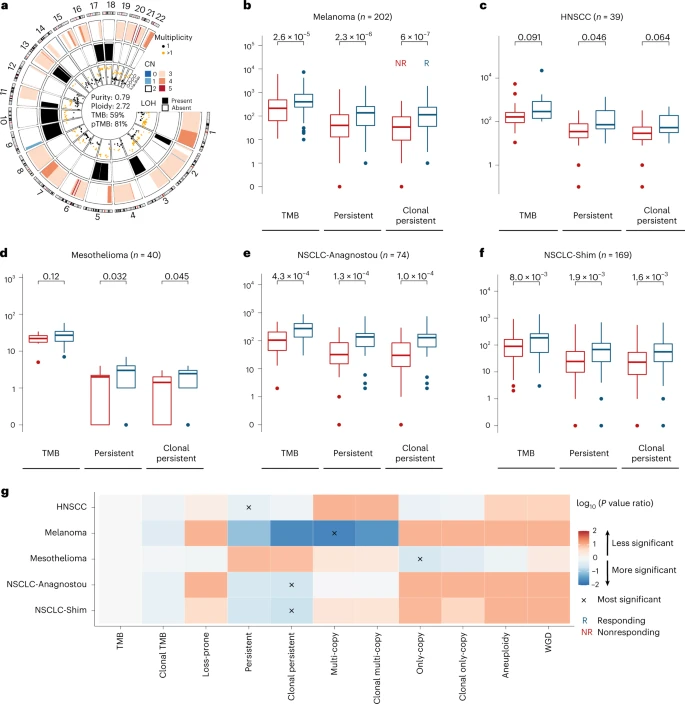
Figure 3
作者假设具有高pTMB的肿瘤对免疫系统,因为pTMB持续暴露在免疫系统下,能够用来预测免疫治疗反映。为此,作者评估了 pTMB、多拷贝和单拷贝突变在预测 524 名melanoma、NSCLC、mesothelioma 和 HNSCC 患者的 ICB 反应方面的潜力。 作者发现高 pTMB 的肿瘤在免疫治疗中有着更高的治疗反应率。而单独使用 TMB 或易丢失突变的数量不能很好地区分有反应和无反应的肿瘤(图 3作为说明 pTMB 和 TMB 之间差异的代表性示例)。高 pTMB 更准确地区分黑色素瘤队列中有反应和无反应的肿瘤(n = 202,Mann–Whitney U 检验,pTMB、克隆 pTMB、易丢失突变负荷和 TMB 分别为 P = 2.3 × 10-6,P = 6.0 × 10-7,P = 1.92 × 10-3 和 2.6 × 10−5 ;图 3b)。同样,HNSCC ICB (图 3c),mesothelioma cohort pTMB 在预测对 durvalumab plus platinum-pemetrexed 化疗的反应方面优于 TMB(图 3d),较高的 pTMB 区分有反应和无反应的 NSCLC(NSCLC-Anagnostou,NSCLC-Shim,图 3e、f)。
接下来作者评估了pTMB、易丢失突变和TMB对临床结果的影响大小(effect size),在melanoma, HNSCC and mesothelioma队列中,pTMB的效应量最大(HNSCC: pTMB Cohen’s d = −0.96, TMB d = −0.64, loss-prone d = −0.61; melanoma: pTMB d = −0.57, TMB d = −0.44, loss-prone d = −0.35; mesothelioma: pTMB d = −0.74, TMB d = −0.51, loss-prone d = −0.58)。在 NSCLC 队列中,pTMB 的效应量虽然非常接近 TMB。这些发现表明,在免疫治疗下,TMB 区分有反应和无反应的能力在很大程度上是由它们的pTMB驱动,支持基于肿瘤pTMB的肿瘤分类可以改善免疫治疗反应预测。
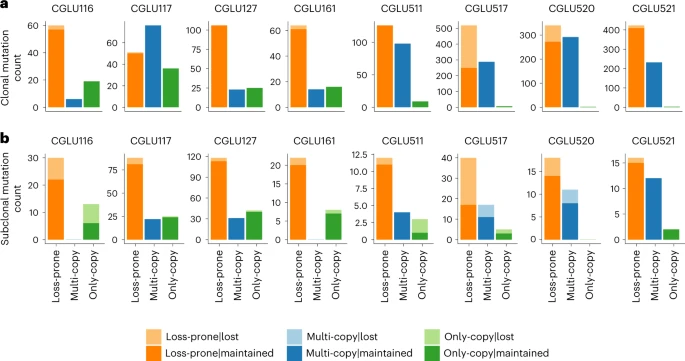
Figure 4
为了确定肿瘤进化下pTMB的生物学意义,作者对 免疫治疗前后的一系列肿瘤样本进行了全外显子组测序分析。 作者假设在免疫治疗的选择性压力下不会消除克隆性pTMB,因为它们不太可能在治疗的背景下进行亚克隆消除,也不太可能因染色体缺失而丢失(突变位于单拷贝区域可能是致病性的和突变位于多拷贝区域在生物学上不太可能被清除)。 与作者的假设一致,在分析来自 8 名接受 ICB 治疗的患者的治疗前和获得性耐药的 NSCLC 患者时,作者发现克隆性pTMB和易丢失突变之间的丢失频率存在显着差异。 在基线肿瘤中检测到的 2,836 个克隆突变中,共有 363 个在后代肿瘤中丢失。 其中,绝大多数是克隆性易丢失突变(363 个中的 358 个,98.6%)。 在所分析的 8 名患者中,有 6 名未在后代肿瘤中丢失pTMB,而在剩下的两名患者中,每名患者都有两个未在后代肿瘤中检测到的克隆多拷贝突变,这表明丢失率极低 (克隆性多拷贝突变:1,031 例中有 4 例丢失(0.4%),克隆性单拷贝突变:117 例中有 1 例丢失(0.9%);图 4)。 这些分析支持了在肿瘤进化过程中保留的持久性突变pTMB的稳健性和生物学基础。
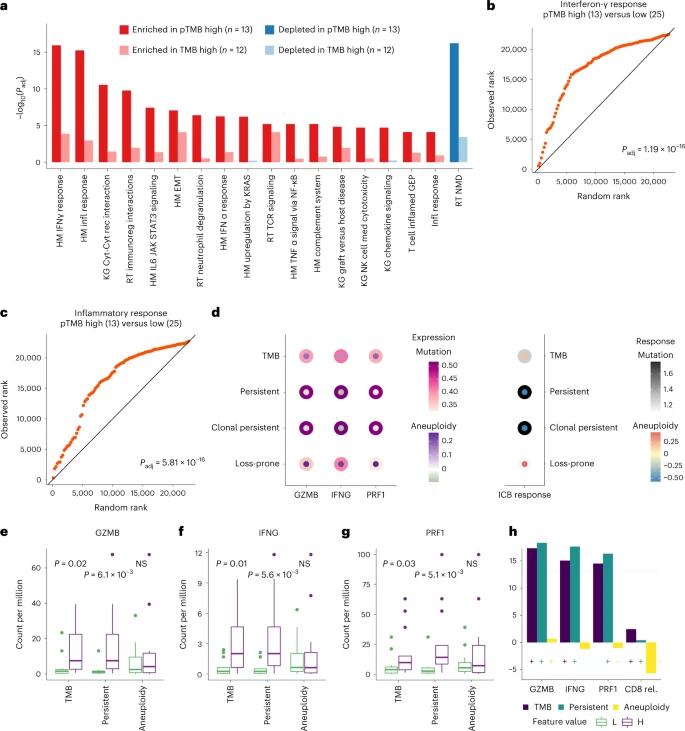
Figure 5
接下来作者转移到肿瘤免疫微环境TME上,探讨了经过ICB治疗的肿瘤免疫微环境的转录组学变化。作者的假设是,高pTMB会持续性将新抗原暴露给免疫系统,进而触发干扰素-γ 信号传导和适应性免疫级联反应,并进一步在ICB免疫治疗中增强。ICB 治疗的黑色素瘤的RNA 测序分析显示高 pTMB 肿瘤患者在治疗前干扰素-γ 和炎症反应相关基因组显着富集(图 5a-c),并在 ICB 治疗期间显著增强。值得注意的是,在按 TMB 含量分层的肿瘤患者中,促炎基因组的差异富集减少了(图 5a,),在比较由 pTMB 分层的 TCGA 组中黑色素瘤的 TME 的转录组学分析中观察到类似的趋势。作者还发现 pTMB 与 CD8 和 CD4 T 细胞丰度相关。接下来,作者研究了 pTMB、肿瘤非整倍性和细胞溶解活性的关系。 发现,在 TCGA 中,与 TMB 高或非整倍性低的肿瘤相比,pTMB 高的细胞溶解标志物表达更高。在基于 pTMB 和非整倍性对关键细胞溶解基因的表达进行建模时,作者发现高 pTMB 抵消了非整倍性对细胞溶解活性和 ICB 反应的负面影响(但在统计学上不显着)(图 5 )。
综上所述,作者的分析表明,高 pTMB 可能代表适应性免疫反应的“不可编辑(不容易被丢失)”目标集。 该假设依赖于 pMANA 不太可能因肿瘤的内在适应性而被染色体丢失消除,因此可能介导持续的新抗原驱动的免疫反应和长期临床收益。通过将分析限制在具有计算推断的高 MHC I 类结合亲和力 的 MANA 子集,作者没有观察到 pMANA 性能的进一步改善,这突出了 MANA 预测算法在识别生物学相关新表位方面的局限性。 为此,作者试图生成额外的功能证据,证明 pMANA 确实被识别并引发表位特异性 T 细胞扩增和来自 NSCLC 患者的脉冲自体 T 细胞,其多肽来自pTMB和易丢失突变。 除了一个引发 T 细胞受体 (TCR) 克隆型扩增的肽外,所有肽均由pTMB编码,表明 pMANA 被 CD8+ T 细胞识别并进一步支持其生物学重要性。
这篇文章的研究结果表明,高 pTMB 是总体 TMB 的tumor foreignness生物学相关衡量指标,代表了适应性免疫反应的“不可编辑”目标集,并且可能作为持续免疫肿瘤控制的内在驱动因素发挥作用,因为在癌症进化过程中新抗原无法轻易通过染色体缺失而丢失。pTMB 依赖的是pMANA 介导持续新抗原驱动的免疫反应,通过在体外测试 pMANA 特异性 TCR 克隆型扩增,作者证明 pMANA 可以引发记忆 T 细胞反应,同时考虑 pTMB 和克隆异质性可能最有助于预测对免疫疗法的反应。
####################################################################
#版权所有 转载请告知 版权归作者所有 如有侵权 一经发现 必将追究其法律责任
#Author: Jason
#####################################################################
文章作者 zzx
上次更新 2023-05-02
